同科生物23分型HPV检测试剂 助力宫颈癌筛查
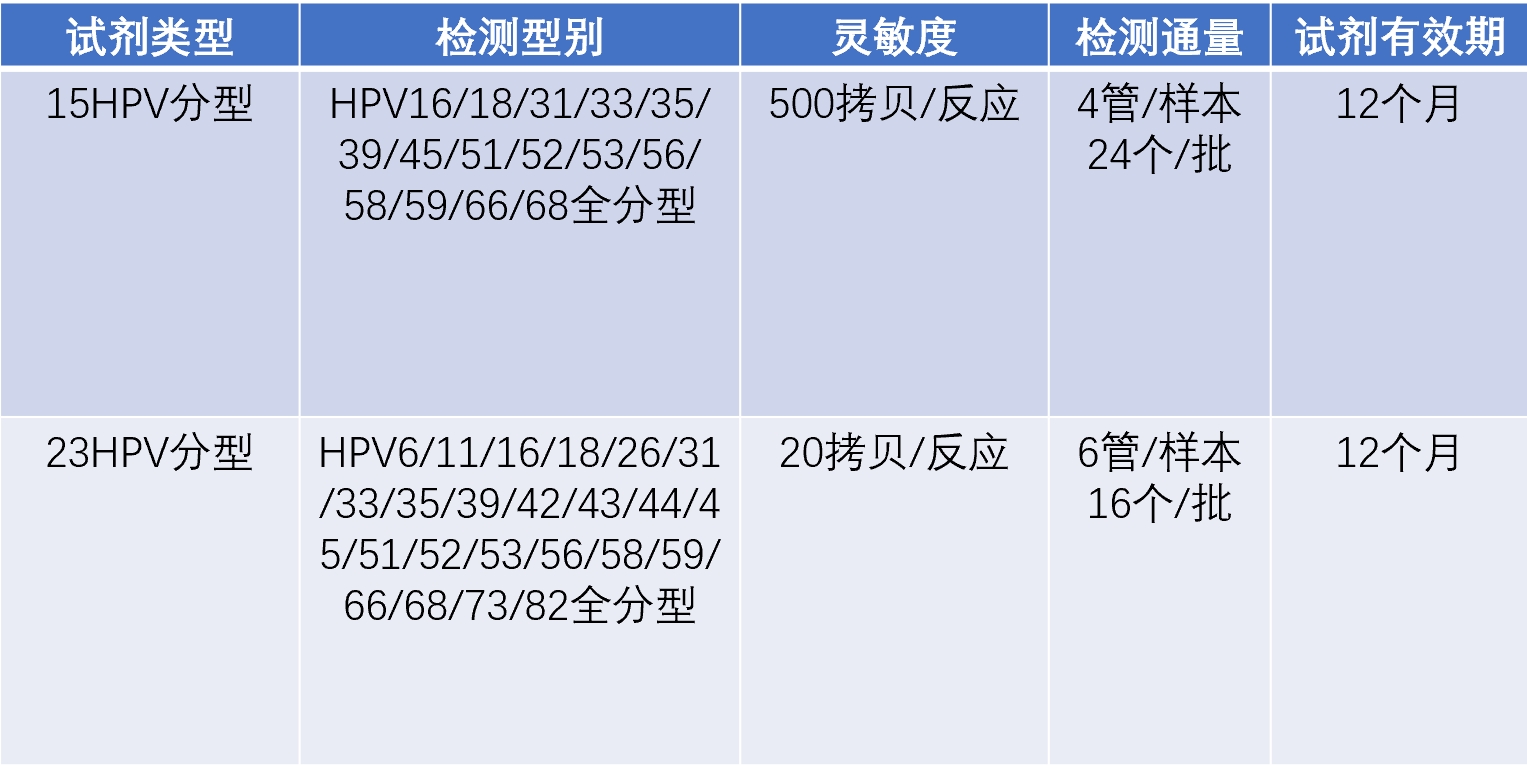
近期,同科生物研发的人乳头瘤病毒核酸分型检测试剂盒(PCR-荧光探针法),正式获批国家药品监督管理局颁发的《医疗器械注册证》(体外诊断试剂)(注册证编号:国械注准20253400210),预期用途:用于体外定性检测人宫颈脱落细胞中的人乳头瘤病毒(HumanPapillomavirus, HPV)DNA,试剂盒可以检测HPV6、11、16、18、26、31、33、35、39、42、43、44、45、51、52、53、56、58、59、66、68、73和82共23种型别,并对23种HPV进行具体分型。
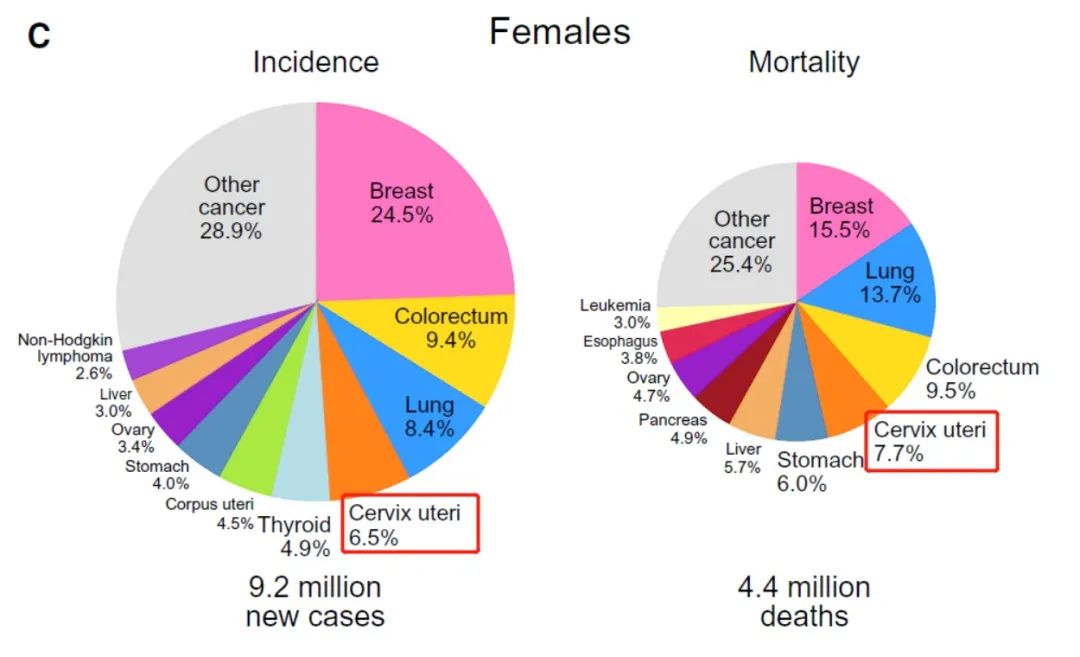

中国作为全球子宫颈癌负担大国,2020年子宫颈癌新增病例和死亡病例分别达到10.97万例和5.91万例,占全球的18.2%和17.3%[2] ,且发病率和死亡率仍呈上升趋势[3] ,且发病年龄趋于年轻化,子宫颈癌的防控形势仍然十分严峻。
人乳头瘤病毒(human papillomavirus, HPV) 疫苗接种、筛查和治疗三级预防策略的有效衔接是推动子宫颈癌疾病全周期管理、提升综合防控服务能力的关键举措。
然而,在预防性HPV 疫苗接种尚未纳入我国免疫规划的背景下,当前我国子宫颈癌三级预防策略的实施仍面临适龄女性HPV疫苗接种率低、诊治能力参差不齐等现实问题,子宫颈癌筛查仍是我国子宫颈癌防控的核心手段,也是早发现、早诊断、早治疗宫颈病变的重要防控手段。
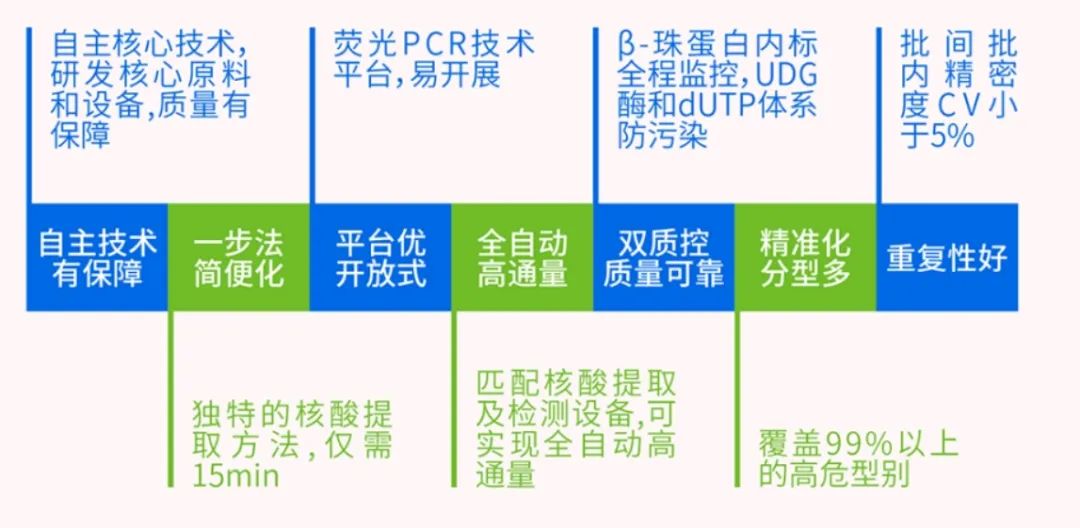
目前,宫颈癌筛查主要的两种方法为子宫颈细胞学检查和HPV DNA 检测。其中,细胞学检查在我国使用更普遍,但其存在灵敏度低、结果具有主观性、质量难以保证等问题。相较于细胞学检查,HPV DNA检测技术具有灵敏度高、重复性高等特点,可检出更多的宫颈癌和癌前病变。

参考文献:
[1] Sung H, Ferlay J, Siegel RL,et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA Cancer JClin, 2021,71 (3):209-249.
[2] World Health Organization.Global strategy to accelerate the elimination of cervical cancer as a public health problem [Z]. 2020.
[3] 赵方辉, 陈号, 夏昌发, 等. 中国女性宫颈癌负担快速上升的原因及其应对措施[J]. 中华流行病学杂志, 2022,43(5):761-765.

